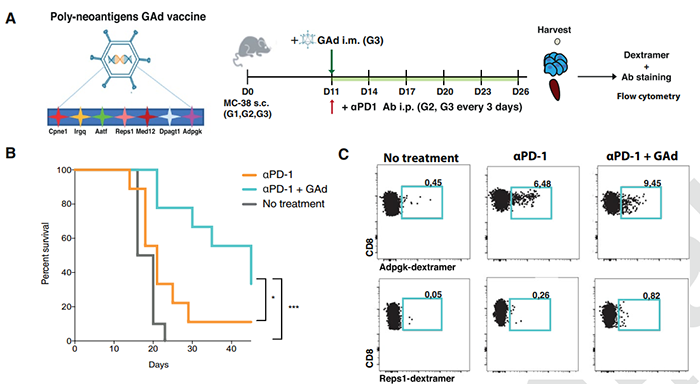
近日,来自意大利基因组学研究所的Luigia Pace等团队在Science Translational Medicine杂志上合作发表了一篇题为 Adenoviral-based vaccine promotes neoantigen-specific CD8+ T cell stemness and tumor rejection 的文章,他们证明了肿瘤新表位的大猩猩Ad(GAd)疫苗通过提高免疫原性和抗肿瘤功效来增强对 PD-1治疗的反应,Ad疫苗结合抗PD-1疗法不仅增加了小鼠多功能新抗原特异性 CD8+ T细胞的数量,并在引流淋巴结中积累了Tcf1+干细胞样祖细胞和肿瘤中的效应CD8+ T细胞。这些发现表明,通过促进免疫原性和拓宽肿瘤浸润的新抗原特异性T细胞,克服对PD-1阻断剂的耐药性是一种很有前景的机制。为了产生针对肿瘤特异性新抗原的Ad疫苗,作者选择了七种预测的免疫原性新表位,它们来源于小鼠 MC38 结直肠腺癌细胞系的肿瘤特异性点突变,将它们头尾相连克隆到GAd载体中。紧接着,作者在皮下接种MC38肿瘤的小鼠中评估GAd疫苗+αPD-1的有效性。与αPD-1单药治疗相比,接受GAd和PD-1联合治疗的小鼠的抗肿瘤控制增强,总生存期增加,引流淋巴结、肿瘤和脾脏中Db -Adpgk+ CD8+ T细胞频率显著增加,与此同时,这些部位中的CD127+ KLRG1-记忆前体细胞数量也明显增加。
图1. GAd疫苗接种与αPD-1治疗相结合,通过增加小鼠中新表位反应性CD8+ T细胞的数量来减少肿瘤生长。
为了进一步表征联合治疗诱导的新抗原特异性CD8+ T细胞亚群的异质性和基因表达程序,作者通过scRNA-seq分析从引流淋巴结和肿瘤中获取的Db -Adpgk+ CD8+ T细胞,并根据不同细胞簇的分布评估特定簇是否与特定治疗相关。不同组别(无瘤、荷瘤、单独治疗、联合治疗)中的Db -Adpgk+ CD8+ T细胞具有明显区分的分布模式,其中,联合治疗能促进Db -Adpgk+ CD8+ T细胞分化为淋巴结中的TSTEM前体和肿瘤中的效应子亚群。作者利用Smart- Seq2测序数据在单细胞水平上分析全长αβ TCR链序列也进一步确认了GAd疫苗+αPD-1能够强烈促进TCR的克隆型扩增,以及在淋巴结和肿瘤中的多样化。Nous-209疫苗目前正在对转移性胃、结肠直肠和GEJ dMMR肿瘤联合PD-1 pembrolizumab (NCT04041310)的患者进行1期试验。受试者接受一次GAd疫苗后在接受三次MVA(即修饰的安卡拉痘苗)免疫接种,每3周用αPD-1治疗,他们表现出Nous-209联合PD-1阻断后持久的新表位特异性T细胞反应。为了探索治疗后TCR库的变化,作者比较了三名患者在匹配的治疗前和治疗中肿瘤中TCR库。与小鼠的结果一致,所有三名患者的T细胞浸润分析在Nous-209治疗后TCR-β拷贝数增加,突出了克隆型的扩展和多样化。总之,这项工作支持开发用于基于肿瘤新抗原的免疫疗法的病毒载体疫苗。转移性癌症患者临床应用的一个主要挑战是需要快速制造和及时向患者提供个性化定制的疫苗。为此,该团队开发了一种快速生产病毒载体的方法,该病毒载体编码60种独特的患者特异性新抗原,并于最近在转移性黑色素瘤和非小细胞肺癌患者中启动一项临床试验 (NCT04990479)。http://doi.org/10.1126/scitranslmed.abo7604